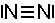Atome, zwischen denen kovalente Bindungen vorliegen, bilden Moleküle.
Dabei können die Atome gleichartig oder verschieden sein.
So liegt zum Beispiel Stickstoff nie atomar vor, sondern immer als Molekül.
| N2 |
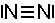 |
Die Molekülmasse berechnet sich durch einfache Addition der Atommassen der beteiligten Bindungspartner.
| Bsp: |
Molekül |
Atommassen [g/mol] |
Molekülmasse [g/mol] |
| |
HCl |
H = 1,00
Cl = 35,45 |
1,00 + 35,45 = 36,45 |
| |
CH4 |
H = 1,00
C = 12,01 |
12,01 + (4 · 1,00) = 16,01 |
| |
H2SO4 |
H = 1,00
S = 32,07
O = 16,00 |
(2 · 1,00) + 32,07 + (4 · 16,00) = 98,07 |
In einem Molekül werden die Kerne in einem bestimmten Abstand zueinander gehalten.
Die mittlere Entfernung zwischen zwei Atomkernen ist die Bindungslänge.
Die Bindungslänge variiert in Abhängigkeit der Bindungspartner und kann zwischen 70 und 300 pm liegen.
| Bsp: |
H – H |
74 pm |
|
C – H |
109 pm |
|
N – H |
96 pm |
|
C – C |
154 pm |
|
O – H |
107 pm |
|
C = C |
133 pm |
© Prof. Dr. J. Gasteiger, A. Hofmann, CCC Univ. Erlangen, Fri Mar 30 11:41:13 2001 GMT
 BMBF-Leitprojekt Vernetztes Studium - Chemie BMBF-Leitprojekt Vernetztes Studium - Chemie
|


 BMBF-Leitprojekt Vernetztes Studium - Chemie
BMBF-Leitprojekt Vernetztes Studium - Chemie