Zum Aufbrechen der Ionenbindungen im Kristall wird beim Lösungsprozeß Energie benötigt.
Man bezeichnet diese Energie als Gitterenergie. Bei der Hydratation der nun isolierten Ionen durch
das Lösungsmittel wird Energie frei: die Hydratationsenergie. Die Differenz aus beiden ergibt
die Lösungswärme:
Lösungswärme = Hydratationsenergie – Gitterenergie
Ist die Hydratationsenergie größer als die Gitterenergie, wird beim Lösen Energie
frei, das Gemisch erwärmt sich. Im umgekehrten Fall kommt es zu einer Abkühlung.
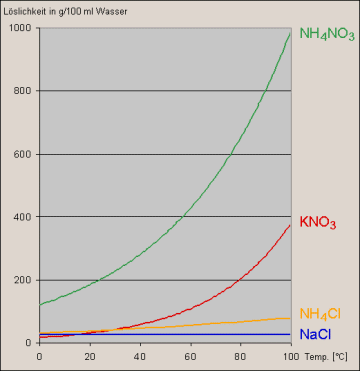
Muß zum Lösen viel Energie aufgewendet werden, beispielsweise bei Kaliumnitrat
(KNO3) und Ammoniumnitrat (NH4NO3), steigt die Löslichkeit
mit der Temperatur stark an. Salze mit kleinen Lösungswärmen, wie z.B. Kochsalz (NaCl),
zeigen nur eine geringe Temperaturabhängigkeit der Löslichkeit.
|
|
|
| Salz |
Lösungswärme |
| Ammoniumnitrat |
NH4NO3 |
25,7 kJ/mol |
| Kaliumnitrat |
KNO3 |
34,9 kJ/mol |
| Ammoniumchlorid |
NH4Cl |
14,6 kJ/mol |
| Kochsalz |
NaCl |
3,8 kJ/mol |
|


 BMBF-Leitprojekt Vernetztes Studium - Chemie
BMBF-Leitprojekt Vernetztes Studium - Chemie