| Verteilungsgleichgewichte |
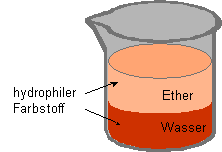 |
Betrachten wir hier nochmals ein Zweiphasensystem, bestehend aus Wasser
und Diethylether. Ein polarer organischer Farbstoff löst sich in beiden
Flüssigkeiten, aufgrund seiner Polarität aber bevorzugt in dem polaren
Lösungsmittel, also in Wasser. Der Farbstoff ist hydrophil.
In unserem Gefäß befindet sich somit unten eine intensiv gefärbte
wässrige Lösung, auf der die leichtere, nicht mit Wasser mischbare, etherische
Phase schwimmt. Diese ist nur wenig gefärbt. |
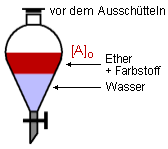
Angenommen, wir hätten eine etherische Lösung dieses Farbstoffs, und wollen den Farbstoff
aus dem Ether entfernen. Dies läßt sich durch Ausschütteln mit Wasser bewerkstelligen.
([A]1 bezeichnet in den Grafiken die Konzentration des Farbstoffes in der organischen
Phase, [A]2 die Konzentration in der wässrigen Phase. [A]o ist die
Ausgangskonzentration, also [A]1 + [A]2.)
Die organische Lösung wird in einen Schütteltrichter gegeben und Wasser zugesetzt. Vor dem
Schütteln befindet sich der Farbstoff vollständig in der Etherphase, das Wasser ist
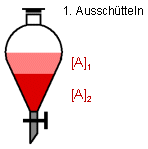
farblos. Beim ersten Ausschütteln geht ein großer Teil des Farbstoffs in die wässrige
Phase über, da der Farbstoff ja hierin besser löslich ist. Wir erhalten eine dunkelrote
wässrige Lösung, die etherische Phase ist nun deutlich heller. Durch Öffnen des
Abflußhahnes am Schütteltrichter kann die wässrige Phase abgelassen werden.
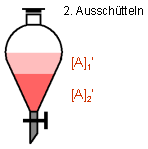
Gibt man frisches Wasser hinzu und wiederholt den Ausschüttelprozeß, wird erneut
ein Großteil des verbliebenen Farbstoffs im Wasser gelöst, die Färbung der
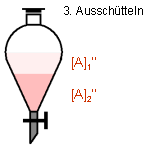
organischen Phase wird heller. Nach mehreren Ausschüttelvorgängen mit jeweils frischer
Wasserzugabe ist der Farbstoff praktisch vollständig aus der organischen Phase entfernt.
© Prof. Dr. J. Gasteiger, Dr. A. Schunk, CCC Univ. Erlangen, Fri Mar 30 11:41:29 2001 GMT
 BMBF-Leitprojekt Vernetztes Studium - Chemie BMBF-Leitprojekt Vernetztes Studium - Chemie
|


 BMBF-Leitprojekt Vernetztes Studium - Chemie
BMBF-Leitprojekt Vernetztes Studium - Chemie