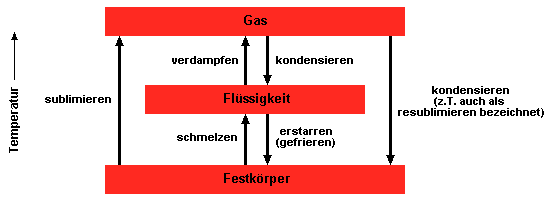
Ändert sich die Temperatur, gehen viele Stoffe in einen anderen Aggregatzustand
über: von fest nach flüssig oder von flüssig nach gasförmig
und umgekehrt. Man bezeichnet einen solchen Prozeß als Phasenumwandlung.
Die Temperatur, bei der feste und flüssige Phase im Gleichgewicht stehen,
ist der Schmelzpunkt. Flüssige und
gasförmige Phase stehen am Siedepunkt
im Gleichgewicht. Reine Stoffe haben charakteristische Schmelz- und Siedepunkte,
die genau gemessen werden können.
 |
Mit der Temperatur ändert sich die kinetische Energie der Teilchen eines
Stoffes. Am Schmelzpunkt ist die kinetische Energie der Teilchen so hoch,
daß sie sich aus dem Kristallgitter zu lösen beginnen. Für
diesen Vorgang muß Energie aufgewendet werden. Deshalb bleibt beim Schmelzen
die Temperatur des Systems trotz Energiezufuhr konstant. Die für die
vollständige Phasenumwandlung erforderliche Energie wird Schmelzwärme
genannt. Beim Verdampfen einer Flüssigkeit muß die
Verdampfungswärme aufgewendet werden,
um die Teilchen aus dem Verband zu lösen.
Die kinetische Energie der Teilchen ist ungleichmäßig verteilt.
Deshalb gibt es in einer Flüssigkeit immer auch Teilchen, die bereits
unter dem Siedepunkt den Verband verlassen: sie verdunsten. Die durchschnittliche
kinetische Energie der Teilchen in der Flüssigkeit sinkt dadurch und
somit die Temperatur der Flüssigkeit. Auf diesem Prinzip basiert die
Wärmeabfuhr unseres Körpers durch Transpiration.


 BMBF-Leitprojekt Vernetztes Studium - Chemie
BMBF-Leitprojekt Vernetztes Studium - Chemie
