In welchem Aggregatzustand sich ein Stoff befindet, hängt nicht nur
von der Temperatur sondern auch vom Druck ab. Die Phasendiagramme
von Wasser und Kohlendioxid verdeutlichen diesen Zusammenhang.
 |
|
 |
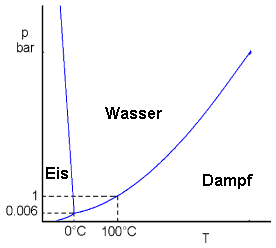
| Phasendiagramm von H2O |
|
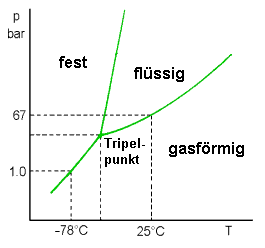
Phasendiagramm von CO2 |
Dem Phasendiagramm für Wasser kann man z.B. entnehmen, daß bei
Drucken unter dem Normdruck von 1,013 bar das Wasser schon bei Temperaturen
unter 100 °C siedet. Deshalb muß auch das Frühstücksei
im Hochgebirge länger als drei Minuten gekocht werden. Umgekehrt liegt
Wasser bei hohen Drucken auch bei Temperaturen über 100 °C noch als
Flüssigkeit vor. Die so erreichbaren höheren Temperaturen des Wassers
werden beim Kochen mit Dampfdrucktöpfen und zur Sterilisation in Autoklaven
genutzt. Der Phasenübergang fest-flüssig zeigt eine Anomalie des
Wassers auf: Der Schmelzpunkt sinkt mit zunehmendem Druck. Eis hat eine kleinere
Dichte als flüssiges Wasser. Wenn man es stark komprimiert, wird deshalb
die Bildung des dichteren Wassers bereits bei niedrigeren Temperaturen eintreten.
Kohlendioxid liegt bei Normbedingungen als Gas vor. Deshalb geht festes Kohlendioxid
(Trockeneis) bei Raumtemperatur direkt vom festen in den gasförmigen
Zustand über: es sublimiert.
Am Tripelpunkt stehen alle drei Phasen im Gleichgewicht. Der Tripelpunkt
des Wassers liegt bei 273,16 K und 0,0061 bar und dient als Fixpunkt der internationalen
Temperaturskala.


 BMBF-Leitprojekt Vernetztes Studium - Chemie
BMBF-Leitprojekt Vernetztes Studium - Chemie

