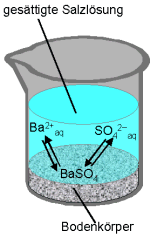
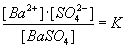Auch schwerlösliche Salze lösen sich zu einem kleinen Teil in Wasser. Es liegt dann eine
gesättigte Lösung vor, wobei sich zwischen dem Bodenkörper (dem ungelösten Salz) und
der Lösung ein Gleichgewicht einstellt. Es werden ständig Ionen gelöst bzw. ausgeschieden,
die Konzentrationen der gelösten Ionen bleiben aber konstant. Dieses Gleichgewicht kann mit dem
Massenwirkungsgesetz beschrieben werden:
BaSO4  Ba2+aq + SO42–aq
Ba2+aq + SO42–aq
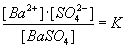
Da die Konzentration des Bodenkörpers konstant ist, kann sie mit der Gleichgewichtskonstanten
zusammengefaßt werden. Man erhält als neue Konstante das Löslichkeitsprodukt Lp:
Lp = [Ba2+] · [SO42–] = 16·10–10 mol2/l2
Aus dem Löslichkeitsprodukt kann nun die Löslichkeit berechnet werden.
Da es sich um eine 1:1-Verbindung handelt, sind die Konzentrationen von [Ba2+] und
[SO42–] gleich groß:
[Ba2+] = [SO42–] = ÖLp = 4·10–5 mol/l
Die Einheit des Löslichkeitsproduktes hängt von der Zahl der Ionen pro Formeleinheit ab.
Dazu einige Beispiele:
| BaSO4 |
Lp = [Ba2+] · [SO42–] |
= 1,6·10–9 mol2/l2 |
| AgCl |
Lp = [Ag+] · [Cl–] |
= 1,7·10–10 mol2/l2 |
| CaF2 |
Lp = [Ca2+] · [F–]2 |
= 1,7·10–10 mol3/l3 |
| Fe(OH)3 |
Lp = [Fe3+] · [OH–]3 |
= 5,0·10–38 mol4/l4 |
|


 BMBF-Leitprojekt Vernetztes Studium - Chemie
BMBF-Leitprojekt Vernetztes Studium - Chemie
 Ba2+aq + SO42–aq
Ba2+aq + SO42–aq