Der menschliche Organismus enthält durchschnittlich etwa 2 g Zink. Zink gehört damit zu den
häufigen Spurenelementen. Zinkionen befinden sich im aktiven Zentrum einiger Enzyme, beispielsweise
in der Alkohol-Dehydrogenase (ADH, oxidiert Ethanol zu Acetaldehyd) und in der Carboanhydrase (katalysiert
die Einstellung des CO2/HCO3–-Gleichgewichts).
In anderen Metalloproteinen dienen Zinkionen zur Stabilisierung der Tertiär- oder Quartärstruktur.
Beispielsweise bildet Insulin mit Zinkionen Komplexe. Hexamere Zink-Komplexe sind vermutlich die aktive Form
dieses Hormons. Werden die Zinkionen durch andere Komplexbildner entfernt, scheint die Wirkung des Insulins
nachzulassen.
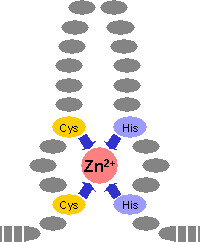
Auch in den Zinkfinger-Proteinen dient das Zink zur Strukturstabilisierung.
Zinkfinger-Proteine gehören zu den "Gen-anschaltenden" Transkriptionsfaktoren. Insbesondere viele
Rezeptoren für Steroid-Hormone gehören zu diesem Typ. Nach der Aktivierung binden die Proteine an die
DNA. Dieser Vorgang initiiert über noch nicht vollständig aufgeklärte Prozesse die Transkription.
Zink wird in diesen Proteinen durch vier Aminosäurereste komplexiert. Meist wirken zwei Sulfid-Reste
aus Cystein und zwei Imidazolringe aus Histidin als Liganden. |


 BMBF-Leitprojekt Vernetztes Studium - Chemie
BMBF-Leitprojekt Vernetztes Studium - Chemie