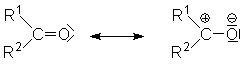Die C=O-Doppelbindung ist im Gegensatz zur C=C-Doppelbindung stark polarisiert.
Die ungleiche Verteilung der Ladung ist noch ausgeprägter als bei Alkoholen,
weil sich die elektronenziehende Tendenz des Sauerstoffatoms noch stärker
auf die p-Bindung als auf die s-Bindung
auswirkt. Formelmäßig lässt sich dies durch folgende Grenzstrukturen
zum Ausdruck bringen:
Am Carbonyl-C-Atom befindet sich eine positive Partialladung, am Sauerstoffatom
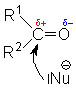
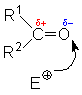
eine negative. Nucleophile greifen deshalb am C-Atom an. Elektrophile am Sauerstoffatom:
 |
 |
| Nuclephiler Angriff am C-Atom (mit positiver Partialladung) |
Elektrophiler Angriff am O-Atom (mit negativer Partialladung) |
Durch die sp2-Hybridisierung des C-Atoms liegen alle unmittelbar
mit dem Carbonyl-C-Atom verbundenen Atome in einer Ebene. Die polarisierte
p-Bindung und die planare Geometrie sind entscheidend
für alle Reaktionstypen der Carbonylverbindungen.


 BMBF-Leitprojekt Vernetztes Studium - Chemie
BMBF-Leitprojekt Vernetztes Studium - Chemie