| Chemie für Mediziner |
| Atombau |
| Periodensystem |
| Chemische Bindung |
| Heterogene Gleichgewichte |
| Reaktionen der Stoffe |
| Säuren & Basen |
| Energetik & Kinetik |
| Oxidation & Reduktion |
| Metallkomplexe |
| Kohlenwasserstoffe |
| Isomerie organischer Verbindungen |
| Funktionelle Gruppen |
| Carbonylverbindungen |
| Einführung |
| Beispiele |
| Eigenschaften |
| Herstellung |
| polare Bindung |
| Tautomerie |
| Nucleophile Angriffe |
| Chinone |
| Carbonsäuren |
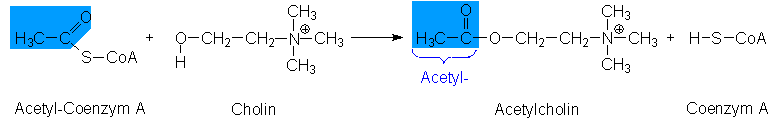
| Derivate |
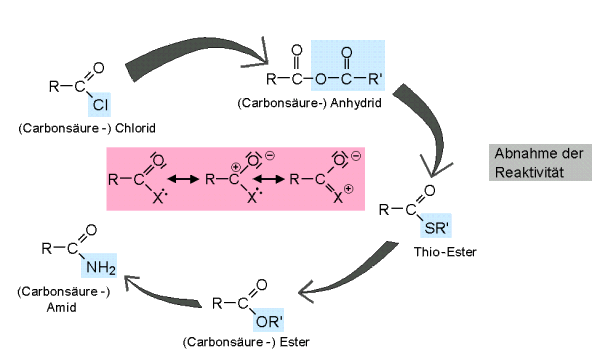
| Carbonsäure-Derivate | |
| Reaktivität | |
| Carbonsäureester | |
| Eigenschaften von Estern | |
| Carbonsäureamide | |
| Derivate anorganischer Säuren | |
| Phosphorsäureester | |
| Schwefelsäurederivate |
| Lipide |
| Zusammenfassung |
| Kohlenhydrate |
| Aminosäuren |
| Heterocyclen & Naturstoffe |
| Vitamine & Coenzyme |
| Literatur |
| Startseite |
© Prof. Dr. J. Gasteiger, S. Spycher, CCC Univ. Erlangen, Thu Apr 25 13:32:19 2002 GMT  BMBF-Leitprojekt Vernetztes Studium - Chemie BMBF-Leitprojekt Vernetztes Studium - Chemie
|