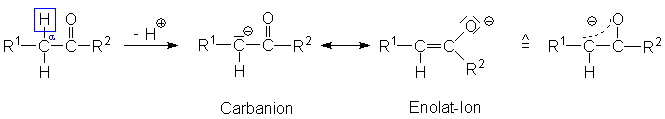
Die Polarität der C=O-Doppelbindung wirkt sich auch auf die C-H-Bindungen
am benachbarten C-Atom aus – dem sogenannten a-stšndigen
C-Atom. Starke Basen können ein Proton des a-stšndigen
C-Atoms abspalten (bei einem Alkan ist dies praktisch unmöglich).
Die (schwache) Acidität ist bedingt durch die Stabilisierung des Anions,
dessen Grenzstrukturen oben dargestellt sind.
Ein Proton in der Lösung kann sich an zwei Orten wieder an das Anion
anlagern:
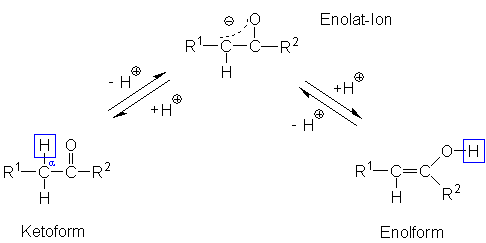
1. Am a-ständigen C-Atom: Es bildet sich
wieder die ursprüngliche Ketoform.
2. Am Enolat-O-Atom: Es bildet sich ein Enol. Der Name weist auf die Doppelbindung
(" -en") und die OH-Gruppe (" -ol") hin.
Ketoform und Enolform stehen miteinander in einem Gleichgewicht. Beide Molekülformen
können sich reversibel ineinander umlagern. Man nennt dieses Phänomen
ein tautomeres Gleichgewicht oder einfach Tautomerie (nicht zu verwechseln
mit Mesomerie, bei der nur eine Molekülform vorliegt, die durch verschiedene
Grenzstrukturen beschrieben wird).


 BMBF-Leitprojekt Vernetztes Studium - Chemie
BMBF-Leitprojekt Vernetztes Studium - Chemie