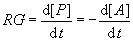Die Reaktionskinetik befaßt sich mit der Geschwindigkeit von Reaktionen und den Faktoren,
die die Reaktionsgeschwindigkeit beeinflussen. Die Reaktionsgeschwindigkeit ist definiert als
die Ableitung der Konzentration nach der Zeit:
A ® P
Man kann hierbei die Konzentrationsänderung (pro Zeiteinheit) der Produkte [P] oder die
der Edukte [A] betrachten. Während der Reaktion nimmt [P] zu, [A] ab.
Betrachtet man die Reaktionsgeschwindigkeit als Abnahme der Edukte, besitzt die
Gleichung ein negatives Vorzeichen.
Die Konzentrationsänderungen können auf sehr unterschiedliche Weise verfolgt werden.
Sind Edukte und Produkte gefärbt, kann man den Reaktionsverlauf direkt beobachten.
Ist dies nicht möglich oder zu ungenau, kommen beispielsweise spektroskopische oder
elektrochemische Verfahren (Photometrie, Leitfähigkeitsmessung etc.) in Frage.


 BMBF-Leitprojekt Vernetztes Studium - Chemie
BMBF-Leitprojekt Vernetztes Studium - Chemie