Ein Katalysator beschleunigt eine Reaktion, ohne dabei selbst verbraucht zu werden.
Viele exotherme und exergone Reaktionen laufen bei Raumtemperatur extrem langsam ab, sie sind
gehemmt. Durch Katalysatoren läßt sich diese Hemmung aufheben, die Reaktion kann
stattfinden.
Wichtig: Der Katalysator beeinflußt nicht die Lage eines
Gleichgewichts, das Gleichgewicht wird
durch den Katalysator nur schneller erreicht. Verschiedene Katalysatoren haben dabei eine
unterschiedliche Wirksamkeit.
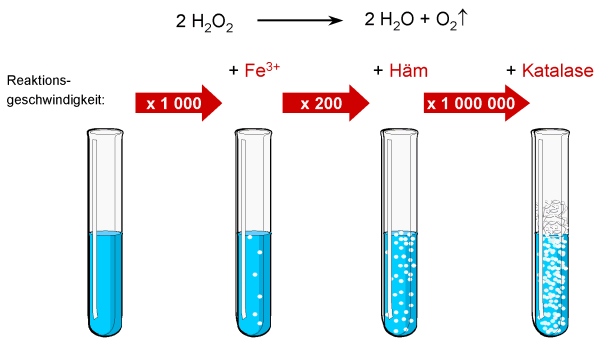
Am Beispiel des Zerfalls von Wasserstoffperoxid (H2O2)
wird die Wirkung von verschiedenen eisenhaltigen Katalysatoren schematisch gezeigt. Der nicht
katalysierte Zerfall ist sehr langsam, es kann keine Bildung von Gasblasen beobachtet werden.
Schon die Zugabe eines Millimols/l Fe3+-Ionen beschleunigt die Reaktion um
das 1000-fache. Wird statt Fe3+ Häm zugegeben, läuft die Reaktion
nochmals deutlich schneller. Die Katalase, ein Häm-haltiges Enzym, ist auf die
Zersetzung von H2O2 spezialisiert. Entsprechend heftig wird
die Reaktion bei deren Zugabe.
 Übungsaufgabe zur Katalyse
Übungsaufgabe zur Katalyse


 BMBF-Leitprojekt Vernetztes Studium - Chemie
BMBF-Leitprojekt Vernetztes Studium - Chemie