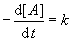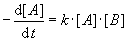Die Reaktionsgeschwindigkeit hängt in der Regel von den Konzentrationen der beteiligten Stoffe
ab. Die allgemeine Gleichung (das sogenannte Geschwindigkeitsgesetz) lautet:
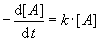 a a |
Der Exponent a gibt dabei die Reaktionsordnung an. Ist a = 1,
handelt es sich um eine Reaktion erster Ordnung. Die Reaktionsgeschwindigkeit ist proportional zur
Konzentration [A]. Viele Zerfallsreaktionen verlaufen 1. Ordnung. Reaktionen zwischen zwei
Molekülen sind meist von zweiter Ordnung. Bei Reaktionen nullter Ordnung ist die
Reaktionsgeschwindigkeit nicht konzentrationsabhängig.
k bezeichnet die Reaktionsgeschwindigkeitskonstante.
| A ® P |
0. Ordnung |
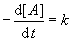 |
| |
1. Ordnung |
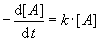 |
| A + B ® P |
2. Ordnung |
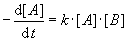 |


 BMBF-Leitprojekt Vernetztes Studium - Chemie
BMBF-Leitprojekt Vernetztes Studium - Chemie
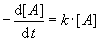 a
a