| Reaktionen (pseudo)-nullter Ordnung |
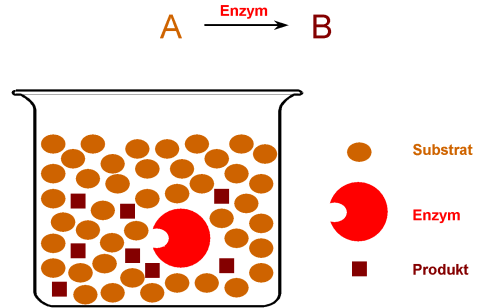
Besonders bei enzymatischen Reaktionen beobachtet man oft, daß die Reaktionsgeschwindigkeit
nicht von der Konzentration des Substrates (dem Edukt von Enzymreaktionen) abhängt,
die Reaktionsordnung also null ist. Geschwindigkeitsbestimmend ist bei diesen Reaktionen
die Konzentration des Enzyms, die viel kleiner als die des Substrates ist. Da das Enzym bei
der Reaktion aber nicht verbraucht wird, erscheint es nicht im Geschwindigkeitsgesetz.
Erst wenn so viel Substrat umgesetzt wurde, daß dessen Konzentration in der gleichen
Größenordnung wie die Enzymkonzentration ist, gegen Ende der Reaktion also,
ist auch ein Einfluß der Substratkonzentration sichtbar: die Reaktion ist dann
1. Ordnung.
Auf diesen Mechanismen beruht die Michaelis-Menten-Kinetik.
© Prof. Dr. J. Gasteiger, Dr. A. Schunk, CCC Univ. Erlangen, Fri Mar 30 11:42:07 2001 GMT
 BMBF-Leitprojekt Vernetztes Studium - Chemie BMBF-Leitprojekt Vernetztes Studium - Chemie
|


 BMBF-Leitprojekt Vernetztes Studium - Chemie
BMBF-Leitprojekt Vernetztes Studium - Chemie