Die Reaktionsenthalpie DH gibt an, wieviel Wärme bei einer
Reaktion ausgetauscht wird. Ist DH < 0 wird Wärme
frei, die Reaktion ist exotherm. Wenn DH > 0 ist,
muß Energie zugeführt werden, die Reaktion ist endotherm.
Die Entropie S nimmt bei ireversiblen Prozessen zu. Sie ist die Triebkraft der
Wärmeausbreitung und der Diffusion.
Die Gibbs freie Enthalpie DG gibt an, ob eine
Reaktion freiwillig abläuft. Sie kann aus der Enthalpie und der Entropie berechnet werden:
DG =
DH – T·DS
Exergone Reaktionen (DG < 0) laufen freiwillig ab,
endergone (DG > 0) nicht.
Mit der Gibbs freien Enthalpie ist die Gleichgewichtskonstante K verknüpft:
DG =
– R · T · ln K
Die Reaktionsgeschwindigkeit hängt von der Geschwindigkeitskonstante k und der
Reaktionsordnung a ab. Reaktionen 0. Ordnung sind konzentrationsunabhängig.
Die Geschwindigkeitskonstante ist temperaturabhängig.
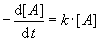 a a |
Damit eine Reaktion stattfinden kann, muß zunächst die Aktivierungsenergie
zugeführt werden. Durch Zugabe eines Katalysators wird die Aktivierungsenergie verringert.
Der Katalysator beschleunigt die Reaktion, ohne jedoch die Lage eines Gleichgewichtes zu
beeinflussen.
Bei biochemischen Prozessen sind die Enzyme als besonders selektive Katalysatoren aktiv.
 Übungsaufgaben zur Energetik und Kinetik
Übungsaufgaben zur Energetik und Kinetik


 BMBF-Leitprojekt Vernetztes Studium - Chemie
BMBF-Leitprojekt Vernetztes Studium - Chemie
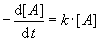 a
a