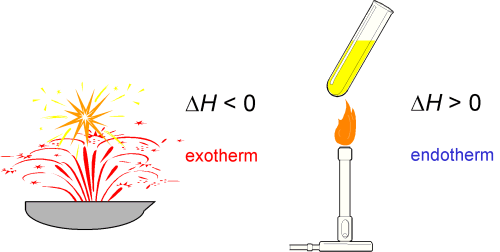
Die Reaktionsenthalpie (DH) gibt an, wieviel Wärme
bei einer Reaktion frei wird oder zugeführt werden muß (bei konstantem Druck).
Ist die Enthalpie negativ (DH < 0), bedeutet dies, daß
bei der Reaktion Energie frei wird. Solche Prozesse nennt man exotherm. Ist
DH > 0, muß dem System Energie zugeführt werden,
die Reaktion ist endotherm.
Betrachtet man die Reaktion eines Mols eines Stoffes bei Standardbedingungen
(25°C = 298 K, 1013 mbar = 101,3 kPa),
erhält man die Standard-Reaktionsenthalpie DH°:
H2 + ½ O2 ® H2O
DH° = –286 kJ/mol
Die Reaktion von Wasserstoff und Sauerstoff, also die Bildung von Wasser aus den Elementen, ist
stark exotherm. Sie läuft bei Zündung eines Sauerstoff-Wasserstoff-Gemisches schlagartig mit
einem lauten Knall ab, man bezeichnet sie daher als "Knallgasreaktion".
Für die Rückreaktion, also die Zerlegung von Wasser in die Elemente, ist eine Energie
von +286 kJ/mol nötig; da die Hinreaktion exotherm ist, ist die Rückreaktion endotherm.


 BMBF-Leitprojekt Vernetztes Studium - Chemie
BMBF-Leitprojekt Vernetztes Studium - Chemie