Der Satz von Heß (Heßscher Wärmesatz) besagt, daß die Reaktionsenthalpie nur
vom Zustand der Edukte und Produkte abhängt, nicht vom Reaktionsverlauf und der Anzahl der Schritte.
Durch Anwendung des Satzes von Heß können Reaktionsenthalpien indirekt bestimmt werden,
die experimentell nicht direkt gemessen werden können, beispielsweise die Bildungsenthalpie
von Kohlenmonoxid (CO):
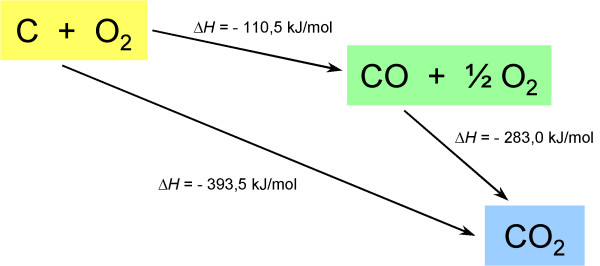
| C + O2 |
® |
CO2 |
DH°1 = –393,5 kJ/mol |
experimentell bestimmt |
| CO + ½ O2 |
® |
CO2 |
DH°2 = –283,0 kJ/mol |
experimentell bestimmt |
|
| C + ½ O2 |
® |
CO |
DH° = –110,5 kJ/mol |
berechnet aus
DH°1 – DH°2 |
| |
 |
© Prof. Dr. J. Gasteiger, Dr. A. Schunk, CCC Univ. Erlangen, Fri Mar 30 11:42:02 2001 GMT
 BMBF-Leitprojekt Vernetztes Studium - Chemie BMBF-Leitprojekt Vernetztes Studium - Chemie
|


 BMBF-Leitprojekt Vernetztes Studium - Chemie
BMBF-Leitprojekt Vernetztes Studium - Chemie
