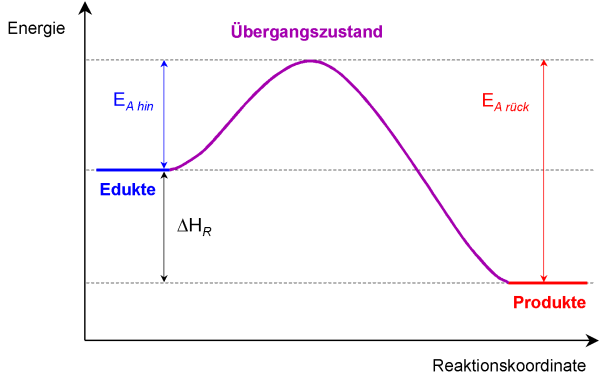
Damit die Teilchen überhaupt reagieren, müssen sie erst angeregt werden. Man muß jedem
Teilchen eine bestimmte Energiemenge, die Aktivierungsenergie EA, zuführen.
Dadurch wird es in einen instabilen Übergangszustand versetzt, von dem aus die Reaktion zum
Produkt weiterläuft. Im Schaubild ist ein Energieprofil für eine exotherme Reaktion
aufgetragen. Die Energiedifferenz zwischen Edukten und Produkten ist die Reaktionsenthalpie
DHR. Bevor diese frei werden kann, muß erst die
Aktivierungsenergie EAhin zugeführt werden. Ausgehend vom Übergangszustand
wird dann die Summe DHR+EAhin abgegeben.
In diesem Diagramm sieht man weiterhin, daß für die Rückreaktion als
Aktivierungsenergie ein höherer Betrag nötig ist, da der Übergangszustand
um DHR weiter von den Produkten entfernt ist.
Die Reaktionskoordinate symbolisiert in diesem Diagramm den Reaktionsverlauf von den Edukten
zu den Produkten.


 BMBF-Leitprojekt Vernetztes Studium - Chemie
BMBF-Leitprojekt Vernetztes Studium - Chemie