| Reaktionen pseudo-erster Ordnung |
Bei Reaktionen, die in Lösung ablaufen, stimmen die beobachteten Reaktionsordnungen oft
nicht mit den erwarteten überein. Betrachten wir als Beispiel die Hydrolyse von Saccharose
("Rohrzuckerinversion").
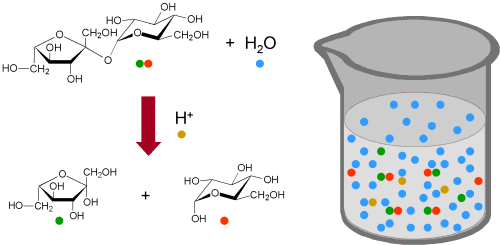
Bei dieser Reaktion wird Saccharose (Rohrzucker) durch eine verdünnte Säure
in Glucose (Traubenzucker) und Fructose (Fruchtzucker) gespalten.
Formal reagiert je ein Molekül Saccharose mit je einem Wassermolekül.
Die Protonen nehmen an der Reaktion zwar teil, werden aber nicht verbraucht. (Sie sind
ein Katalysator.)
Man würde daher eine Reaktion 2. Ordnung vermuten.
Untersucht man die Konzentrationsabhängigkeit dieser Reaktion, findet man nur einen
Einfluß der Saccharose-Konzentration, die experimentelle Reaktionsordnung ist 1.
Die Ursache hierfür liegt in dem großen Überschuß des Lösungsmittels
Wasser (von 1 : 100 oder mehr). Während die Hälfte der Saccharose
bereits gespalten wurde, ist bei unserem Beispiel nur 0,5% des Wassers verbraucht worden.
Die Wasserkonzentration hat sich fast nicht geändert, die Reaktion scheint die
Wasserkonzentration nicht zu beeinflussen. Man nennt solche Reaktionen pseudo-erster Ordnung.
 |
© Prof. Dr. J. Gasteiger, Dr. A. Schunk, CCC Univ. Erlangen, Fri Mar 30 11:42:07 2001 GMT
 BMBF-Leitprojekt Vernetztes Studium - Chemie BMBF-Leitprojekt Vernetztes Studium - Chemie
|


 BMBF-Leitprojekt Vernetztes Studium - Chemie
BMBF-Leitprojekt Vernetztes Studium - Chemie
