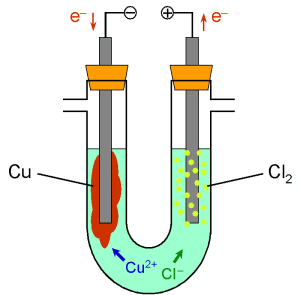
Die Vorgänge in einer elektrochemischen Zelle lassen sich auch umkehren. Wird an die Elektroden
eine Spannung angelegt, erfolgt eine Elektrolyse. Bei der Elektrolyse wird die Salzlösung (oder
Salzschmelze) zersetzt. In der Grafik ist die Elektrolyse einer Kupferchlorid-Lösung schematisch
dargestellt.
An die beiden Elektroden wird eine Spannung angelegt. Aufgrund der elektrostatischen Anziehung wandern
die positiv geladenen Kationen (Cu2+) zum Minuspol, zur Kathode. Die Anionen (Cl–)
werden vom Pluspol, der Anode, angezogen. An den Elektroden laufen nun Redox-Vorgänge ab:
| Kathode: |
Cu2+ + 2 e– |
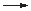 |
Cu |
Reduktion |
| Anode: |
2 Cl– |
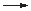 |
Cl2 + 2 e– |
Oxidation |
Durch Elektrolyse können viele Metalle chemisch rein aus ihren Verbindungen gewonnen werden.
Die Elektrolyse in wässriger Lösung ist jedoch nur bei edlen Metallen (E° > 0 V)
möglich. Bei unedlen Metallen würde sich nicht das Metall abscheiden, sondern Wasserstoff
entstehen.


 BMBF-Leitprojekt Vernetztes Studium - Chemie
BMBF-Leitprojekt Vernetztes Studium - Chemie