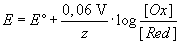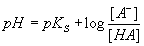| Chemie für Mediziner |
| Atombau |
| Periodensystem |
| Chemische Bindung |
| Heterogene Gleichgewichte |
| Reaktionen der Stoffe |
| Säuren & Basen |
| Energetik & Kinetik |
| Oxidation & Reduktion |
| Einführung |
| Redox-Reaktionen |
| Oxidationszahlen |
| Redox-Gleichungen |
| Höllenstein |
| Elektrochemische Zellen |
| Elektrochemische Potentiale |
| Elektrolyse |
| Korrosion |
| Nernstsche Gleichung |
| Vergleich Redox-Reaktionen / Säuren & Basen |
| pH-Abhängigkeit von Potentialen |
| Die Atmungskette |
| Zusammenfassung |
| Metallkomplexe |
| Kohlenwasserstoffe |
| Isomerie organischer Verbindungen |
| Funktionelle Gruppen |
| Carbonylverbindungen |
| Kohlenhydrate |
| Aminosäuren |
| Heterocyclen & Naturstoffe |
| Vitamine & Coenzyme |
| Literatur |
| Startseite |
|
© Prof. Dr. J. Gasteiger, Dr. A. Schunk, CCC Univ. Erlangen, Fri Mar 30 11:42:28 2001 GMT
 BMBF-Leitprojekt Vernetztes Studium - Chemie
BMBF-Leitprojekt Vernetztes Studium - Chemie