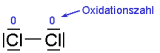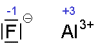Die Oxidationszahl gibt die formale Ladung des jeweiligen Atoms an. Aus der Differenz der Oxidationszahlen
vor und nach der Reaktion ist ersichtlich, wieviele Elektronen das Atom (bzw. Ion) aufgenommen oder abgegeben hat.
| Bei Elementen ist die Oxidationszahl stets = 0: |
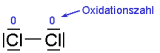 |
| Bei einfachen Ionen entspricht die Oxidationszahl der Ladung des Ions: |
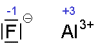 |
Bei Molekülen muß die formale Ladung jedes Atoms bestimmt werden.
Die Bindungselektronen werden dem Atom mit der größeren Elektronegativität
zugeordnet. Nun wird die Valenzelektronenzahl des Atoms in der Verbindung
mit der Zahl der Außenelektronen im neutralen Atom (bei Hauptgruppenelementen
ist dies die Nummer der Gruppe im alten PSE = römische Ziffern) verglichen.
Die Differenz ergibt die formale Ladung des Atoms in der Verbindung und diese ist
gleich der Oxidationszahl.
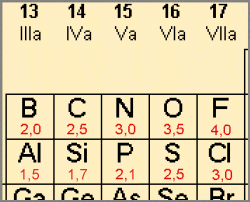
Ausschnitt aus dem Periodensystem
rote Zahlen: Elektronegativität |
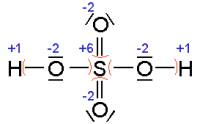
|
Einige wichtige Elemente weisen in den meisten Verbindungen die gleichen Oxidationszahlen auf:
- Sauerstoff: fast immer -2 (außer in H2O2, dort -1)
- Wasserstoff: fast immer +1 (außer in Hydriden, z.B. NaH, dort -1)
- Alkalimetalle (Na+, K+, ...): +1
- Erdalkalimetalle (Ca2+, Ba2+, ...): +2
- Halogene (F–, Cl–, ...): -1
© Prof. Dr. J. Gasteiger, Dr. A. Schunk, CCC Univ. Erlangen, Fri Mar 30 11:42:20 2001 GMT
 BMBF-Leitprojekt Vernetztes Studium - Chemie BMBF-Leitprojekt Vernetztes Studium - Chemie
|


 BMBF-Leitprojekt Vernetztes Studium - Chemie
BMBF-Leitprojekt Vernetztes Studium - Chemie