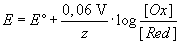Bei Redox-Reaktionen werden zwischen den Reaktionspartnern Elektronen ausgetauscht.
Das Reduktionsmittel gibt Elektronen ab, das Oxidationsmittel nimmt sie auf.
Bei Redox-Reaktionen ändern sich die Oxidationszahlen mindestens eines Atoms des
Reduktions- und eines Atoms des Oxidationsmittels.
Redox-Prozesse sind reversibel. Sie können zwischen Festkörpern, in
Schmelzen, in der Gasphase oder in Lösungen ablaufen.
Taucht ein Metall in eine Salzlösung dieses Metalles, erhält man eine
Halbzelle. An der Oberfläche des Metalls laufen Redox-Prozesse ab.
Zwischen zwei durch eine Salzbrücke verbundenen Halbzellen kann eine
Spannung gemessen werden. Wird die Spannung zwischen einer Halbzelle und der
Standardwasserstoff-Elektrode gemessen, erhält man das Standardpotential
der Zelle. Werden die Redox-Systeme nach steigendem Standardpotentiale
geordnet, ergibt sich die Spannungsreihe. Metalle mit negativen
Potentialen bezeichnet man als unedel, solche mit positivem Potential als
edel. Unedle Metalle reagieren mit verdünnten Säuren unter
Bildung von Wasserstoff.
Die Halbzellen-Potentiale sind Konzentrationsabhängig.
Die Standardpotentiale (E°) werden mit einmolaren Lösungen gemessen.
Potentiale bei anderen Konzentrationen können mit Hilfe der Nernstschen
Gleichung berechnet werden.
 Physikums-Fragen zu Redox-Reaktionen
Physikums-Fragen zu Redox-Reaktionen


 BMBF-Leitprojekt Vernetztes Studium - Chemie
BMBF-Leitprojekt Vernetztes Studium - Chemie