Das Potential der Standardwasserstoff-Elektrode ist abhängig vom pH-Wert.
Dies wird aus der Reaktionsgleichung
und der daraus formulierten Nernstschen Gleichung deutlich:
2 H3O+ + 2 e–
 H2 + 2 H2O
H2 + 2 H2O
Das Standardpotential E° beträgt hierfür 0 V (bei einem pH-Wert von 0). Für die oxidierte Form wird die Protonen-Konzentration,
für die reduzierte Form die H2-Konzentration eingesetzt. Bei einem Formelumsatz werden zwei
Elektronen übertragen: z = 2.
Die Konzentration von Wasser ist um mindestens das 100fache größer als die Protonen-Konzentration
(bei pH 1: [H3O+] = 0,1 mol/l, [H2O] = 56 mol/l) und ändert sich daher
bei der Reaktion praktisch nicht. Sie kann vernachlässigt werden. [H2] ist bei Standarddruck
(1,013 bar) gleich 1. Die Nernstsche Gleichung vereinfacht sich so zu:
 * * |
Auch alle anderen Redox-Reaktionen, bei denen neben Elektronen auch Protonen ausgetauscht werden,
sind pH-abhängig. Der pH-Wert beeinflußt somit die Potentiale dieser Redox-Prozese.
Umgekehrt ist es möglich, durch entsprechende elektrochemische Zellen pH-Werte zu messen.
* ) log x2 = 2 log x; - log [H3O+] = pH


 BMBF-Leitprojekt Vernetztes Studium - Chemie
BMBF-Leitprojekt Vernetztes Studium - Chemie
 H2 + 2 H2O
H2 + 2 H2O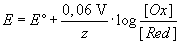
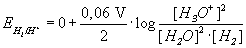
 *
*