 |
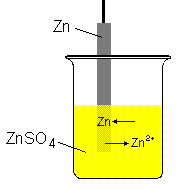
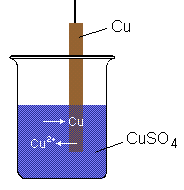
Redox-Reaktionen können nicht nur zwischen Feststoffen, sondern auch
in Lösung ablaufen. Wird ein Metall (z.B. Zink oder Kupfer) in eine Lösung der
entsprechenden Ionen (Zn2+ bzw. Cu2+) gebracht,
erhält man eine Halbzelle. Es stellt sich ein Redox-Gleichgewicht ein: |
 |
Zn2+ + 2 e–
 Zn Zn |
Cu2+ + 2 e–
 Cu Cu |
| Aus dem Metall gehen Ionen in Lösung, wobei das Atom an den Metallstab,
man nennt ihn hier Elektrode, Elektronen abgibt. Aus der Lösung scheiden
sich Ionen unter Aufnahme von Elektronen am Metall ab. |
© Prof. Dr. J. Gasteiger, Dr. A. Schunk, CCC Univ. Erlangen, Fri Mar 30 11:42:22 2001 GMT
 BMBF-Leitprojekt Vernetztes Studium - Chemie BMBF-Leitprojekt Vernetztes Studium - Chemie
|


 BMBF-Leitprojekt Vernetztes Studium - Chemie
BMBF-Leitprojekt Vernetztes Studium - Chemie


 Zn
Zn