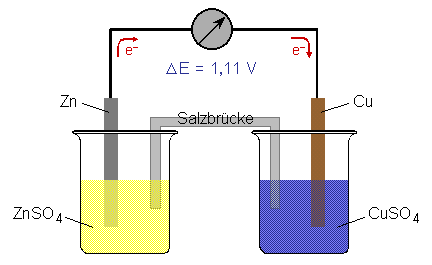
Schaltet man eine Kupfer- und eine Zink-Halbzellen zusammen, indem man die Lösungen mit einer
Salzbrücke (einem mit einer Salzlösung gefüllten Rohr) versieht, so daß eine
stromleitende Verbindung entsteht, kann zwischen
den Metallstäben eine Spannung gemessen werden.
Wird der Stromkreis geschlossen, fließen die Elektronen im externen Stromkreis vom unedleren
Metall zum edleren; beim Daniell-Element somit vom Zink zum Kupfer,
wobei der Pluspol des Elements am Kupfer, der Minuspol am Zink liegt.
An der Zink-Elektrode läuft die Oxidation (Zn ® Zn2+
+ 2 e–), an der Kupfer-Halbzelle die Reduktion (Cu2+
+ 2 e– ® Cu) ab. Die resultierende Redox-Reaktion
lautet somit:
CuSO4 + Zn ® Cu + ZnSO4
Über die Salzbrücke (Ionenfluß) ist der Stromkreis geschlossen.


 BMBF-Leitprojekt Vernetztes Studium - Chemie
BMBF-Leitprojekt Vernetztes Studium - Chemie