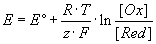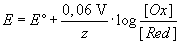Die Redox-Potentiale sind abhängig von den Konzentrationen der reduzierten und
oxidierten Form. Die Nernstsche Gleichung beschreibt diese Beziehung:
E = Potential
E° = Standard-Potential (25°C, 1-molare Lösungen)
R = Gaskonstante
T = (absolute) Temperatur in K
z = Zahl der bei der Reaktion übertragenen Elektronen
F = Faraday-Konstante
Setzt man in die Nernstsche Gleichung die Standard-Temperatur (25°C = 298 K)
sowie die Zahlenwerte für R und F ein, und formt den natürlichen
Logarithmus in den dekadischen um, vereinfacht sich die Gleichung:


 BMBF-Leitprojekt Vernetztes Studium - Chemie
BMBF-Leitprojekt Vernetztes Studium - Chemie