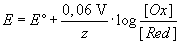Mit dieser Gleichung ist es nun möglich, Potentiale von Zellen zu berechnen, die nicht 1-molare
Lösungen enthalten. Als Beispiel sollen Silberhalbzellen mit unterschiedlicher Silberionen-Konzentration dienen:
| Ag+ + e– |
 |
Ag |
|
Eo = + 0,80 V |
Die reduzierte Form ist elementares Silber: [Red] = [Ag] = 1.
Bei der Reaktion wird ein Elektron übertragen: z = 1.
Die Nernstsche Gleichung lautet für dieses Redox-Gleichgewicht:
E = 0,80 V + 0,06 V · log [Ag+]
Zelle 1
[Ag+] = 0,1 mol/l
E1 = 0,80 V + 0,06 V · log (0,1) = 0,80 V + 0,06 V · (–1) = 0,80 V – 0,06 V = 0,74 V
Das Potential dieser Zelle ist also etwas kleiner als das Standardpotential (bei [Ag+] = 1 mol/l).
Zelle 2
[Ag+] = 0,01 mol/l
E2 = 0,80 V + 0,06 V · log (0,01) = 0,80 V + 0,06 V · (–2) = 0,80 V – 0,12 V = 0,68 V
Werden diese beiden Zellen miteinander verbunden, mißt man zwischen den Elektroden eine Spannung
von:
DE = |E1 – E2| = |0,74 V – 0,68 V| = 0,06 V


 BMBF-Leitprojekt Vernetztes Studium - Chemie
BMBF-Leitprojekt Vernetztes Studium - Chemie