Im Kapitel "Reaktionen der Stoffe" wurde das chemische Gleichgewicht bereits durch das
Massenwirkungsgesetz
beschrieben. Die Gleichgewichtskonstante K steht in Beziehung zur
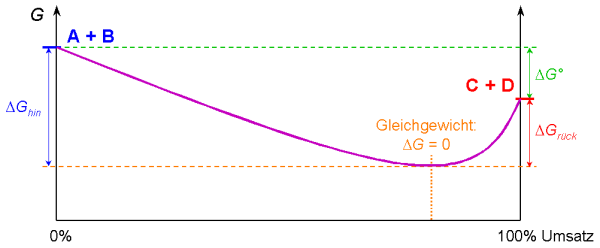
Gibbs freien Enthalpie G. In der Grafik ist die Veränderung von G
im Laufe einer Gleichgewichtsreaktion aufgetragen.
A + B  C + D
C + D
Hat G das Minimum erreicht, hat sich das Gleichgewicht eingestellt (in unserem
Beispiel bei etwa 80%igem Umsatz). Ausgehend von den Edukten A + B
wurde als Energie DGhin frei. Würde man von den Produkten
C + D ausgehen, würde sich das gleiche Gleichgewicht einstellen, es würde aber
weniger Energie frei: DGrück. DG°
bezeichnet die Gibbs freie Standardenthalpie, die bei vollständiger Umsetzung je eines
Mols A + B ® C + D freigesetzt würde:
DG° =
DGhin – DGrück
Weiterhin gilt:
DG =
DG° + RT · ln K
Im Gleichgewicht ist DG = 0. Daraus folgt:
DG° =
– RT · ln K
Mit dieser Gleichung kann aus der Gibbs freien Standardenthalpie auf die Lage des
Gleichgewichts geschlossen werden - oder umgekehrt, nach Berechnung der Gleichgewichtskonstanten K
über das Massenwirkungsgesetz, DG° berechnet werden.
 Übungsaufgabe zur Gibbs freien Enthalpie
Übungsaufgabe zur Gibbs freien Enthalpie


 BMBF-Leitprojekt Vernetztes Studium - Chemie
BMBF-Leitprojekt Vernetztes Studium - Chemie
 C + D
C + D