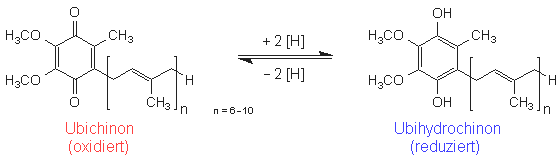Ubichinone kommen in allen bekannten Lebewesen
(Mikroorganismen, Pflanzen und Tieren: ubiquitär =
überall vorkommend) als Redox-Systeme vor.
Sie unterscheiden sich in ihrer Kettenlänge. Beim Menschen findet sich
hauptsächlich Ubichinon mit n = 10 in den Mitochondrien, bei Pflanzen
"Plastochinon" (n = 9) in den Chloroplasten.
Ubichinon kann vom Organismus synthetisiert werden: An den aromatischen
Ring (aus Tyrosin) wird eine Polyprenylgruppe entsprechender Länge gebunden,
anschließend wird der Ring mit den nötigen Substituenten versehen.
Ubichinon (Coenzym Q) spielt eine
entscheidende Rolle in der Atmungskette. Es
nimmt am Komplex I (NADH-Dehydrogenase) die
Reduktionsäquivalente des NADH bzw. am Komplex II
(Succinat-Dehydrogenase) die bei der Oxidation des Succinats (zu Fumarat im Citrat-Zyklus)
auf FAD übertragenen Reduktionsäquivalente auf und wird dabei zu Ubihydrochinon
reduziert. An Komplex III erfolgt die Oxidation des
Ubihydrochinons zu Ubichinon, wobei Cytochrom c reduziert wird.


 BMBF-Leitprojekt Vernetztes Studium - Chemie
BMBF-Leitprojekt Vernetztes Studium - Chemie