Bei einer a-Helix weisen die Peptid-Bindungen in die gleiche Richtung.
Zwischen zwei Amidbindungen liegt der Tetraeder-Winkel von 109,5°.
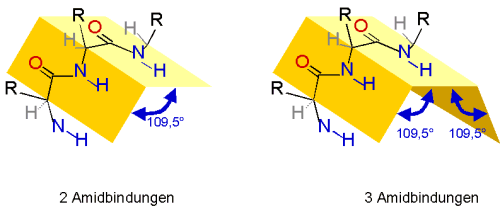
Da um die Amidbindung keine Drehung möglich ist, wird die Kette ab der dritten Bindung
in eine helicale Struktur gezwungen. Diese kann durch Wasserstoffbrücken stabilisiert werden.
Diese Brücken werden zwischen dem Carbonyl-Sauerstoff-Atom einer Bindung und der
H–N-Gruppe der viertnächsten Bindung, diese liegt räumlich der Bindung benachbart,
ausgebildet.
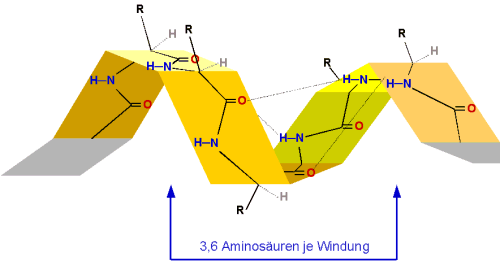
Nach 4 Aminosäuren ist die erste Windung geschlossen. Allerdings überlappen bereits
die erste und vierte Aminosäure. Als Höhe einer Windung ergeben sich rechnerisch
3,6 Aminosäuren, der Abstand beträgt 0,54 nm.
 Physikums-Frage zur a-Helix
Physikums-Frage zur a-Helix


 BMBF-Leitprojekt Vernetztes Studium - Chemie
BMBF-Leitprojekt Vernetztes Studium - Chemie

