| Chromatographische Trennverfahren |
Es gibt sehr viele unterschiedliche chromatographische Trennverfahren. Allen gemeinsam ist,
daß eine mobile Phase (ein flüssiges Laufmittel oder ein Gas) durch eine
stationäre Phase (Feststoff, Gel, in Feststoff absorbierte Flüssigkeit etc.)
durchfließt. Je nach verwendeten Phasen und Durchführung unterscheidet man unter
anderem:
- Säulenchromatographie
- Papierchromatographie
- Dünnschichtchromatographie
- Gaschromatographie
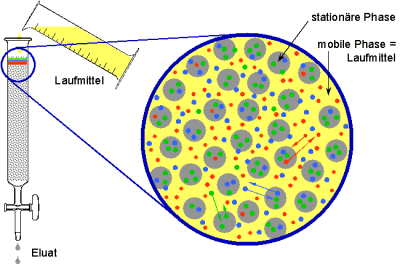
Am Beispiel einer Flüssig-Flüssig-Säulenchromatographie soll hier das
Grundprinzip erläutert werden. Bei der Säulenchromatographie spielen Adsorptions-
und Verteilungsgleichgewichte eine Rolle. Als Säule verwendet man meist ein Glasrohr,
das am unteren Ende einen Hahn trägt. Durch den Hahn kann die durchfließende
Flüssigkeitsmenge gesteuert werden. Zunächst wird die stationäre Phase
mit dem Laufmittel (mobile Phase) getränkt. Nun gibt man oben auf die Säule das
zu trennende Gemisch auf und öffnet leicht den Hahn, so daß das aufgegebene
Gemisch in die Säule einfließt. Laufmittel wird nachgegossen.
|
|
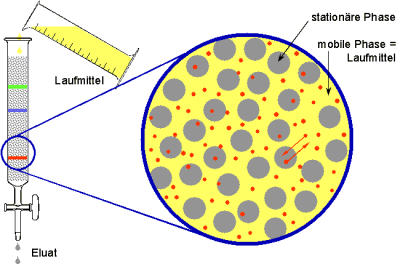
Zwischen Laufmittel und stationärer Phase stellen sich für die einzelnen
Komponenten des Gemischs unterschiedliche Verteilungsgleichgewichte ein. In unserem
Beispiel wird die grüne Substanz besonders gut an der stationären Phase
gebunden, die rote dagegen kaum. Da ständig Laufmittel nachfließt, werden
die Substanzen in unterschiedlichem Umfang durch die Säule transportiert. Die
grünen Moleküle bleiben am längsten auf der stationären Phase
haften und werden daher nicht so schnell weitergetragen wie die blauen, diese
wiederum langsamer als die roten. Daher erreicht die rote Substanz als erste das
Säulenende und kann abgetrennt werden, es folgt nach einiger Zeit die blaue
Verbindung und schließlich die grüne als letze. |
|
© Prof. Dr. J. Gasteiger, Dr. A. Schunk, CCC Univ. Erlangen, Fri Mar 30 11:41:39 2001 GMT
 BMBF-Leitprojekt Vernetztes Studium - Chemie BMBF-Leitprojekt Vernetztes Studium - Chemie
|


 BMBF-Leitprojekt Vernetztes Studium - Chemie
BMBF-Leitprojekt Vernetztes Studium - Chemie

