Der osmotische Druck einer Lösung wird stets auf das reine Lösungsmittel bezogen.
Er hängt nur von der Zahl (der Konzentration) der gelösten Teilchen ab, ist aber unabhängig
von der Art der Teilchen. Eine einmolare wässrige Glucose-Lösung besitzt daher den gleichen
osmotischen Druck wie eine einmolare Lösung von Harnstoff in Wasser.
Der osmotische Druck (posm) ist temperaturabhängig. Er kann nach
folgender Gleichung aus der Konzentration berechnet werden:
posm = [A] · R · T
R = 0,0831 l·bar/mol·K |
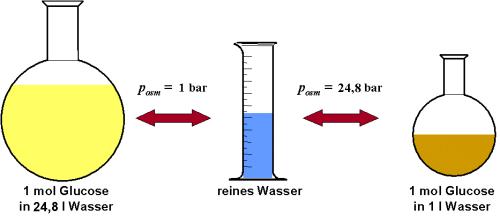 |
Eine einmolare Glucose-Lösung, also eine Lösung von 1 mol Glucose in 1 l Wasser
liefert einen osmotischen Druck von 24,8 bar, eine Lösung von 1 mol Glucose in
24,8 l einen Druck von 1 bar (bei 25°C). |
© Prof. Dr. J. Gasteiger, Dr. A. Schunk, CCC Univ. Erlangen, Fri Mar 30 11:41:34 2001 GMT
 BMBF-Leitprojekt Vernetztes Studium - Chemie BMBF-Leitprojekt Vernetztes Studium - Chemie
|


 BMBF-Leitprojekt Vernetztes Studium - Chemie
BMBF-Leitprojekt Vernetztes Studium - Chemie
