Erythrozyten
Bildquelle: Mortimer: »Chemie«
Stuttgart: Thieme, 1996 (6. Aufl.), S. 211
© Georg Thieme Verlag, Stuttgart, 1996 |
Der osmotische Druck des Blutplasmas entspricht dem einer 0,9%igen Kochsalzlösung
("physiologische Kochsalzlösung").
Berechnung des osmotischen Drucks: (bei 37°C)
0,9% NaCl = 9 g NaCl in 1000 ml Wasser = 9 g/l
Zur Berechnung wird die Molarität [NaCl] benötigt:
Molare Masse M(NaCl) = 58,5 g/mol
Stoffmenge n(NaCl) = m(NaCl) / M(NaCl) = 9 g / 58,5 g/mol = 0,154 mol
[NaCl] = 0,154 mol/l
Zur Berechnung des osmotischen Drucks wird statt des theoretischen Faktors
z = 2 (NaCl ® Na+ + Cl–
= 2 Teilchen)
ein empirisch bestimmter Korrekturfaktor: z = 1,86 verwendet:
posm = z · [NaCl] · R · T
posm = 1,86 · 0,154 mol/l · 0,0831 l·bar/mol·K · 310 K = 7,38 bar
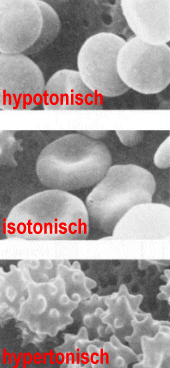
Eine Lösung mit diesem osmotischen Druck nennt man isotonisch. Bringt man Erythrozyten
(oder andere Zellen) in eine hypotonische Lösung (Lösung mit einem geringeren
osmotischen Druck), z.B. destilliertes Wasser, diffundiert Wasser in die Zellen ein. Das Zellvolumen
nimmt zu, die Zellen können sogar platzen. Ist die umgebende Lösung hypertonisch, z.B.
eine 10%ige Kochsalzlösung, diffundiert Wasser aus der Zelle heraus. Das Zellvolumen nimmt
ab, die Erythrozyten nehmen eine stachlige Gestalt an.
|


 BMBF-Leitprojekt Vernetztes Studium - Chemie
BMBF-Leitprojekt Vernetztes Studium - Chemie
