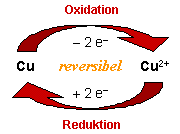
Als Oxidation werden solche Prozesse bezeichnet, bei denen ein Atom, Ion oder Molekül
Elektronen abgibt. Aus einem neutralen Atom wird dann ein Kation, beispielsweise aus Kupfer
Cu2+-Ionen. Dabei ändern sich die Eigenschaften
der Materie: Elementares Kupfer ist ein rot glänzendes, verformbares Metall. Kupferionen
bilden dagegen - gemeinsam mit Anionen - Salze oder liegen gelöst vor.
Solvatisierte Kupferionen besitzen eine Hydrathülle und sind blau gefärbt.
Bei der Reduktion läuft der umgekehrte Vorgang ab: Ein Atom, Ion oder Molekül
nimmt Elektronen auf. In unserem Beispiel nehmen die Cu2+-Ionen
je 2 Elektronen auf und werden wieder zu elementarem Kupfer.


 BMBF-Leitprojekt Vernetztes Studium - Chemie
BMBF-Leitprojekt Vernetztes Studium - Chemie