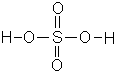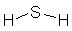Einige Säuren können mehr als ein Proton abgeben. Die Protonenabgabe
erfolgt über mehrere Dissoziationsstufen, wobei die Abgabe in der zweiten
Stufe gegenüber der ersten deutlich erschwert ist. Ein physiologisch
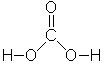
wichtiges Beispiel ist die zweiprotonige Kohlensäure (H2CO3).
| |
|
|
|
konjugierte Säure-Base-Paare |
H2CO3 + H2O
|
 |
HCO3– + H3O+ |
1. Stufe |
H2CO3 / HCO3–
und H3O+ / H2O
|
HCO3– + H2O
|
 |
CO32– + H3O+ |
2. Stufe |
HCO3– / CO32–
und H3O+ / H2O
|
In der ersten Dissoziationsstufe ist HCO3– die
Base, in der zweiten die Säure. HCO3– ist
somit ein Ampholyt.
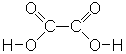
Weitere Beispiele zweiprotoniger Säuren sind die Schwefelsäure,
der Schwefelwasserstoff und die Oxalsäure.


 BMBF-Leitprojekt Vernetztes Studium - Chemie
BMBF-Leitprojekt Vernetztes Studium - Chemie