Die durch den Stoffwechsel umgesetzte Menge H3O+-Ionen
ist beachtlich: Im Ruhezustand 15'000 mmol pro Tag, bei körperlicher
Anstrengung deutlich mehr. Ein paar Zahlen zur Veranschaulichung: Die Menge
würde ausreichen um 15 Liter destilliertes Wasser auf einen pH von
0 anzusäuern. Die Quelle der freigesetzten H3O+-Ionen
ist in erster Linie das Kohlendioxid, das bei der Verbrennung von Kohlenwasserstoffen
frei wird und im Wasser zu Kohlensäure reagiert. Die Stoffmenge von 15'000
mmol freigesetztem Kohlendioxid entspricht einer Masse m von 450 Gramm
umgesetztem Traubenzucker (Glucose). Berechnung: Die Molmasse der Glucose
(C6O6H12) ist 180 g/mol. Ein mol freigesetztes
Kohlendioxid entspricht 1/6 mol umgesetzte Glucose, also gilt m(Glucose)
= (180 g/mol · 15 mol) / 6 = 450 g.
Eine weitere H3O+-Quelle sind auch organische Säuren
und Schwefelsäure, die als nicht-flüchtige Säuren zusammengefasst
werden. Die Schwefelsäure entsteht beim Abbau von Aminosäuren mit
Thiolgruppen (Methionin, Cystein). Im Blut ermöglichen zwei Vorgänge,
dass der pH im gesunden Organismus trotzdem konstant bleibt:
| 1. |
die Abpufferung der H3O+-Ionen, die
beim Stoffwechsel entstehen |
| 2. |
die Elimination von H3O+-Ionen zur
Regeneration der Puffersysteme |
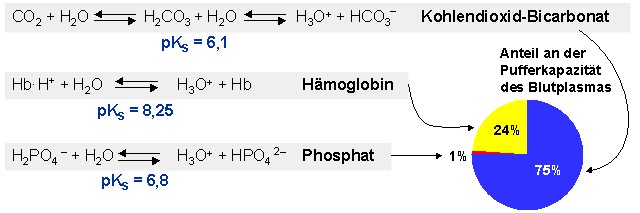
Die anteilsmässig wichtigsten Puffersysteme des Blutes sind der
Kohlendioxid-Bicarbonatpuffer, der Proteinpuffer (insbesondere das Hämoglobin
der Erythrozyten) und der Phosphatpuffer.
Bemerkung: Die pK-Werte sind im Blut und bei 37 °C
etwas niedriger als in einer wässrigen Lösung bei 25 °C.
Die Konzentration der Gesamtpufferbasen des Blutes beträgt 48 mmol/l.
Bei der hohen Säureproduktion des Stoffwechsels wäre die Pufferkapazität
des Blutes schon nach einigen Minuten überschritten. Die Puffersysteme
müssen also schnell regeneriert werden können. Dies erfolgt
über die Abgabe von CO2 in der Lunge durch die Atmung und
durch protonenverbrauchende Reaktionen in der Niere:
| Atmung: |
Entlastung des Körpers von flüchtigen
Säuren (CO2) |
Menge: |
> 15'000 mmol/d |
| Niere: |
Aktive Ausscheidung von Ammonium-Hydrogencarbonat
(NH4HCO3), dessen Bildung aus Glutamin zwei Protonen
verbraucht |
|
10 - 60 mmol/d |


 BMBF-Leitprojekt Vernetztes Studium - Chemie
BMBF-Leitprojekt Vernetztes Studium - Chemie