| Berechnung
des pH-Wertes starker Säuren |
|
Löst man eine oder mehrere Säuren in Wasser, so gilt für den
pH-Wert der Lösung definitionsgemäss: pH = – log [H3O+ ].
Zur Berechnung des pH-Werts muss zwischen Lösungen starker und schwacher
Säuren unterschieden werden.
| Starke Säuren |
| Eine starke Säure liegt in wässriger
Lösung fast ausschliesslich in dissoziierter Form vor (Gleichgewicht
vollständig auf der rechten Seite). |
| HA + H2O |
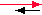 |
H3O+ + A– |
|
| Die Konzentration an H3O+-Ionen entspricht der
eingesetzten Konzentration der Säure, die zu Beginn der Reaktion
vorlag ([HA]0). Löst man zum Beispiel 0,5 mol
der starken Säure HNO3 (Salpetersäure) in einem
Liter Wasser, entstehen 0,5 mol H3O+ und 0,5 mol
NO3–. Die Konzentration an H3O+ beträgt
0,5 mol/l (= 0,5 M). |
Allgemein gilt für starke Säuren:
| Für die 0,5 M Salpetersäure ergibt sich: |
pH = - log 0,5 = 0,3 |
| Löst man nur 10-4 mol Salpetersäure
in einem Liter ergibt sich: |
pH = - log 10-4 = 4 |
| Löst man 10-4 mol Salpetersäure in
einem Milliliter (10-3 l) ergibt sich: |
pH = - log 10-1 = 1 |
| Für starke Basen gilt entsprechend:
|
| pOH = - log [B]0 |
, wobei jeweils der pH-Wert angegeben wird: |
pH = 14 - pOH |
© Prof. Dr. J. Gasteiger, S. Spycher, CCC Univ. Erlangen, Fri Mar 30 11:41:54 2001 GMT
 BMBF-Leitprojekt Vernetztes Studium - Chemie BMBF-Leitprojekt Vernetztes Studium - Chemie
|


 BMBF-Leitprojekt Vernetztes Studium - Chemie
BMBF-Leitprojekt Vernetztes Studium - Chemie