Um nicht immer mit Potenzzahlen rechnen zu müssen, werden logarithmische
Grössen eingeführt. Der pH-Wert wird als negativer dekadischer Logarithmus
der H3O+-Ionenkonzentration definiert.
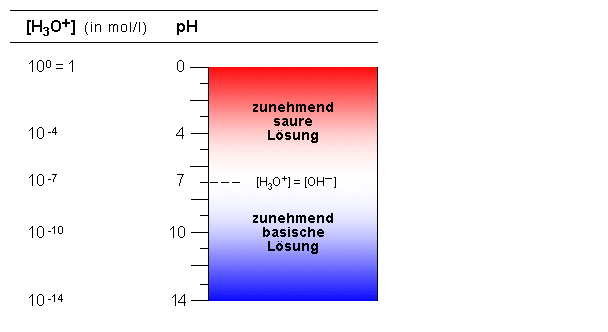
Auf dieser Definition basiert die pH-Skala. Sie reicht von pH = 0
([H3O+] = 1 mol/l = 10 0 mol/l)
bis pH = 14 ([H3O+] = 10 -14 mol/l).
Sinkt der pH-Wert in einer Lösung um eine Einheit (um 1,0), bedeutet
das aufgrund der logarithmischen Skala, dass sich die Hydronium-Ionenkonzentration
um den Faktor 10 erhöht hat und umgekehrt.
| Der pOH-Wert ist analog als negativer dekadischer Logarithmus
der OH –-Ionenkonzentration definiert.
|
| pOH = - log [OH –]
|
| pH und pOH hängen über das Ionenprodukt des Wassers zusammen. Bildet
man den negativen Logarithmus des Ionenprodukts, erhält man
|
| - log KW =
- log ([H3O+]·[OH–]) =
- log 10 -14 = |
pH + pOH = 14 |
|
Hier zeigt sich wie praktisch die logarithmische Einteilung ist. Ist der
pH-Wert bekannt, lässt sich über pOH = 14 - pH
die Hydroxid-Ionenkonzentration sehr einfach berechnen. Die pOH-Skala verläuft
also gegenläufig zur pH-Skala. Ein Beispiel: Bei einem pH von 5 liegt
der pOH bei 9, die Hydroxid-Ionen-Konzentration ist dann [OH–]
= 10-9 mol/l.
| pH-Bereiche in verschiedenen
Nahrungsmitteln und Körperflüssigkeiten: |
|
|


 BMBF-Leitprojekt Vernetztes Studium - Chemie
BMBF-Leitprojekt Vernetztes Studium - Chemie