Im Stoffwechsel laufen zahlreiche Reaktionen ab, bei denen H3O+-Ionen
freigesetzt oder verbraucht werden.
Andererseits ist ein konstanter pH-Wert im Zytoplasma oder in bestimmten Körperflüssigkeiten,
wie z.B. dem Blut, lebenwichtig. Bereits leichte Abweichungen führen
zu schweren Krankheitserscheinungen, starke pH-Änderungen zum Tod. Stoffwechselbedingte
"pH-Stösse" müssen also abgepuffert werden. Im Blut nehmen
verschiedene Puffersysteme diese Funktion war.
Allgemein werden Lösungen, deren pH-Wert sich bei der Zugabe von Säure
oder Base nur wenig verändert, als Pufferlösungen
bezeichnet. Sie enthalten ein konjugiertes Säure-Base-Paar, wobei die
Säure OH–-Ionen neutralisiert, die Base H3O+-Ionen.
Pufferlösungen lassen sich herstellen, indem man
- schwache Säuren mit ihrem Salz (z.B. der Acetatpuffer aus Essigsäure
und Natriumacetat) bzw.
- schwache Basen mit ihrem Salz (z.B. der Ammoniumpuffer aus Ammoniumchlorid
und Ammoniak) mischt.
Sind beide Spezies in genügend grosser Konzentration vorhanden, reagiert
der Acetatpuffer folgendermassen:
| Pufferung der Zugabe starker Säuren
|
H3O+ + CH3COO– |
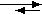 |
CH3COOH + H2O |
Die zugegebene starke Säure reagiert vollständig
zu HOAc. Dass der pH-Wert sich dennoch geringfügig ändert, hat mit
dem – bereits bei der Neutralisation besprochenen – Effekt zu tun, dass die
gebildete Essigsäure wiederum (zu einem geringen Anteil) dissoziieren kann.
| Pufferung der Zugabe starker Basen |
OH– + CH3COOH |
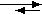 |
CH3COO– + H2O |
Die Pufferwirkung zeigt sich in der Titrationskurve schwacher Säuren
und Basen durch das Plateau im Bereich des pK-Wertes, ist also der Grund für
den geringen Anstieg der Titrationskurve der Essigsäure bei pH 4 bis
6.


 BMBF-Leitprojekt Vernetztes Studium - Chemie
BMBF-Leitprojekt Vernetztes Studium - Chemie