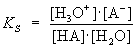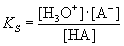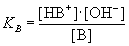| Säuren und Basen dissoziieren in Wasser nicht vollständig,
sondern liegen auch als undissoziierte Moleküle vor. Der Dissoziationsgrad
hängt von der Säurestärke ab. Betrachten wir das Dissoziationsgleichgewicht
einer Säure (für Basen gilt dasselbe): |
| HA + H2O |
 |
H3O+ + A– |
|
| Für starke Säuren liegt das Gleichgewicht weit auf der rechten Seite,
d.h. die Säure liegt nahezu vollständig als H3O+ und
A– vor. Sie ist vollständig dissoziiert. Eine schwache Säure
dagegen ist nur zu einem geringen Teil dissoziiert und liegt zum grössten
Teil als HA vor. |
| Auch für die Dissoziationsreaktionen gilt das Massenwirkungsgesetz. |
|
|
| Da sich in verdünnter Lösung die Konzentration des Wassers kaum
ändert, wird sie in die Konstante einbezogen. |
|
|
|
Analog wird bei den Basen vorgegangen:
|
| B + H2O |
 |
HB+ + OH– |
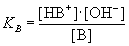 |
KB = Basenkonstante |
|
Die Werte von KS und KB sind das Maß,
ob eine Säure bzw. eine Base stark oder schwach ist. In Tabellenwerken
wird üblicherweise der negative dekadische Logarithmus angegeben:
Eine starke Säure (Gleichgewicht rechts) hat eine grosse Säurekonstante
und somit einen kleinen pKs-Wert und umgekehrt.
pKS und pKB eines konjugierten Säure-Base-Paares
hängen über das Ionenprodukt des Wassers zusammen. Schreibt man
die Reaktionen auf und multipliziert die Säure mit der Basenkonstanten
erhält man Kw. Logarithmisch
geschrieben:
pKS + pKB = 14


 BMBF-Leitprojekt Vernetztes Studium - Chemie
BMBF-Leitprojekt Vernetztes Studium - Chemie