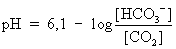Unter pathologischen Bedingungen kann es passieren, dass die Regelsysteme
des Körpers nicht mehr in der Lage sind, den pH-Wert des Blutes konstant
zu halten. Es kommt zu einer starken Anhäufung von Säuren oder Basen
im Blut. Der pH-Referenzbereich des arteriellen Blutes beträgt 7,4 ±
0,03. Fällt der pH-Wert unter 7,37 spricht man von einer Acidose, während
ein Anstieg über 7,43 als Alkalose bezeichnet wird.
Acidosen und Alkalosen können jeweils durch Lungenfunktionsstörungen
(respiratorisch) oder durch Stoffwechselstörungen (metabolisch) verursacht
werden.
Anhand der Henderson-Hasselbalch-Gleichung lassen sich die Ursachen der
unterschiedlichen Störungen diskutieren. Der Säure-Basenstatus
des Blutes lässt sich beschreiben durch: |
|
|
| Im Fall einer Hyperventilation wird in kurzer
Zeit sehr viel CO2 über die Lunge abgeatmet. Die CO2-Konzentration
im Blut nimmt ab, und durch Anstieg des pH-Wertes kommt es zur respiratorischen
Alkalose. Verliert ein Patient andererseits eine grosse Menge nicht-flüchtiger
Säuren (etwa durch Erbrechen von saurem Magensaft) erhöht sich primär
die HCO3–-Konzentration und es kommt zur metabolischen
Alkalose. In der Tabelle sind einige Beispiele aufgelistet. Der Zusammenhang
von Kohlendioxidpartialdruck pCO2 und Konzentration
[CO2] ist durch das Henry-Daltonsche Gesetz gegeben: pCO2
/ [CO2] = K. |
| Zustand |
Charakteristische
Befunde |
Beispiele möglicher
Ursachen |
| |
pH
|
pCO2
[mm Hg]
|
|
|
Metabolische Acidose:
|
< 7,37
|
< 35
|
| • |
vermehrte Produktion organischer Säuren (Diabetes mellitus,
Hunger, Leberversagen) |
| • |
verminderte renale H3O+-Exkretion (z.B.
bei chronischer Niereninsuffizienz) |
| • |
Verlust bicarbonatreicher Sekrete (Diarrhoe, Mißbrauch von
Abführmitteln) |
|
|
Metabolische Alkalose:
|
> 7,43
|
> 45
|
| • |
H3O+-Ionenverlust (Erbrechen von saurem
Magensaft) |
| • |
Übermässige (therapeutische) Bicarbonatzufuhr |
|
Respiratorische
Acidose: |
< 7,37
|
40 ± 5
|
| • |
alveoläre Hypoventilation
(Verlegung der Atemwege, Lähmung der Atemmuskulatur (z.B. bei
Kinderlähmung), Atemwegsobstruktion) |
|
Respiratorische
Alkalose: |
> 7,43
|
40 ± 5
|
| • |
alveoläre Hyperventilation (z.B. aus psychischen Gründen
oder in grossen Höhen) |
|
Der Körper versucht durch Kompensationsmechanismen den pH-Wert wieder
an das physiologische Optimum anzugleichen. Neugeborene etwa weisen in den
ersten Minuten nach der Geburt eine deutliche metabolische Acidose mit pH-Werten
zwischen 7,0 und 7,2 auf. Durch die einsetzende kompensatorische Hyperventilation
stabilisiert sich der pH innerhalb der ersten 2 h auf einem Wert von ungefähr
7,28.
Unter Umständen kann auch eine vollständige Kompensation des pH-Wertes
erfolgen, d.h. ein pH-Wert innerhalb des Referenzbereiches besagt nicht unbedingt, dass keine Störung
im Säure-Basen-Haushalt vorliegt. Deshalb werden als diagnostische Parameter
jeweils pH-Wert, pCO2 und Standard-Bicarbonat (oder alternativ
dazu der Basenüberschuss) erhoben.
Für eine vollständige Behandlung des Themas sei auf die Lehrbücher
der Pathophysiologie verwiesen.


 BMBF-Leitprojekt Vernetztes Studium - Chemie
BMBF-Leitprojekt Vernetztes Studium - Chemie