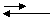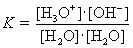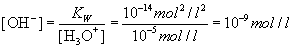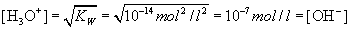| Auch in chemisch reinem Wasser lässt sich eine geringe Leitfähigkeit
messen. Der Grund hierfür ist die Eigendissoziation des Wassers in
Hydronium- und Hydroxid-Ionen. |
H2O + H2O
|
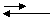 |
H3O+ + OH– |
|
| Für diese Reaktion gilt das Massenwirkungsgesetz: |
|
|
Das Gleichgewicht der Reaktion liegt stark auf der linken Seite, und die
Gleichgewichtskonstante K hat somit einen sehr kleinen Wert. In einer wässrigen
Lösung ist H2O im Überschuss vorhanden ([H2O] =
1000 g/l / 18 g/mol = 55,5 mol/l). Die H2O-Konzentration
bleibt deshalb konstant, und der Nenner kann in die Konstante K mit einbezogen
werden.
K · [H2O]2 = KW [H3O+]·[OH–]
= 10-14 mol2/l2
Die bei gegebener Temperatur konstante Grösse KW kann
durch Leitfähigkeitsmessungen bestimmt werden und wird als Ionenprodukt
des Wassers bezeichnet.
Kennt man die Konzentration der H3O+ -Ionen, so lässt
sich über das Ionenprodukt die Konzentration der OH–-Ionen
berechnen und umgekehrt. Wenn zum Beispiel in einer Messung eine H3O+
-Konzentration von 10-5 mol/l ermittelt wurde, so berechnet
sich folgende OH–-Konzentration:
Die Konzentration der Hydronium- bzw. der Hydroxidionen ist das Maß,
ob und wie stark eine Lösung sauer, basisch oder neutral ist.
| Saure
Lösung |
|
[H3O+] >
[OH–] |
| Neutrale Lösung |
|
[H3O+] = [OH–] |
| Basische
Lösung |
|
[H3O+] <
[OH–] |
| In einer neutralen Lösung sind H3O+ -
und OH–-Konzentration gleich gross. Die Gleichung für das
Ionenprodukt lässt sich dann als KW = [H3O+
]2 schreiben und man erhält die Beziehung: |
|
|


 BMBF-Leitprojekt Vernetztes Studium - Chemie
BMBF-Leitprojekt Vernetztes Studium - Chemie