| Säuren und Basen können ihre Eigenschaften gegenseitig aufheben.
Mischt man zum Beispiel gleiche Mengen Salzsäure und Natronlauge, entsteht
eine Kochsalzlösung mit einem pH-Wert von 7. |
|
|
Die Protonen der Säure werden von der Base aufgenommen. Man nennt diesen
Vorgang Neutralisation.
Bemerkung: Bei der obigen Schreibweise sollte nicht vergessen werden, dass die
Reaktionspartner in Lösung als hydratisierte Ionen vorliegen, wie es z.B.
bei der Schreibweise als Ionenreaktion deutlich wird.
|
| H3O+ + Cl– + Na+ + OH– |
|
Na+ + Cl– + 2 H2O |
|
| Das Natrium-Ion und das Chlorid-Ion sind von der Reaktion
nicht betroffen, sondern bleiben als hydratisierte Ionen in der Lösung.
Die eigentliche Neutralisations-Reaktion besteht darin, dass sich aus
Hydronium- und Hydroxidionen Wasser bildet. |
| H3O+ + OH– |
|
2 H2O |
|
DHo = – 57,3 kJ/mol |
|
| Bei der Reaktion wird Wärme frei, die Reaktionsenthalpie ist negativ. Sie
wird bei dieser Reaktion Neutralisationswärme genannt. |
Neutralisiert man statt einer starken Säure eine schwache Säure
mit Natronlauge, so weist die Lösung keinen neutralen pH-Wert auf, sondern
reagiert basisch. Am Beispiel Essigsäure soll dies diskutiert werden.
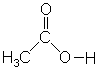 Essigsäure,
CH3COOH
Essigsäure,
CH3COOH
(abgekürzt: AcOH)
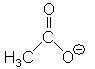
Acetat, CH3COO– (AcO–) |
Gibt man zu einer Essigsäurelösung mit n mol
Essigsäuremolekülen (Gesamtmenge, also dissoziierte und nicht
dissoziierte Form) die gleiche Stoffmenge OH–, reagieren
diese vollständig zu Acetat und Wasser. Eine Acetat-Lösung steht
aber mit ihrer konjugierten Säure im Gleichgewicht:
| CH3COO– + H2O |
|
CH3COOH + OH– |
Die schwache Base Acetat reagiert
zu einem geringen aber nicht mehr vernachlässigbaren Anteil mit Wasser.
Es entstehen OH–-Ionen und der pH steigt etwas an. Würde
man direkt ein Salz einer schwachen Säure wie Natriumacetat (NaOAc)
lösen, würde sich der gleiche pH-Wert einstellen.
Bei der Neutralisation schwacher Basen mit einer starken Säure sinkt
der pH entsprechend unter den Wert von 7. |
|
HA
|
B
|
resultierender pH
|
Beispiele
|
|
stark
|
stark
|
» 7
|
HCl und starke Base
|
|
schwach
|
stark
|
> 7
|
CH3COOH und starke Base
|
|
stark
|
schwach
|
< 7
|
NH3 und starke Säure
|
Neutralisiert man Säuren oder Basen, stellt sich also nicht zwingend
ein neutraler pH-Wert ein. Neutralisation bedeutet
also lediglich, dass äquimolare Mengen Säure und Base zur Reaktion
gebracht werden.
 Physikum-Frage zur Neutralisation
Physikum-Frage zur Neutralisation
© Prof. Dr. J. Gasteiger, S. Spycher, CCC Univ. Erlangen, Fri Mar 30 11:41:55 2001 GMT
 BMBF-Leitprojekt Vernetztes Studium - Chemie BMBF-Leitprojekt Vernetztes Studium - Chemie
|


 BMBF-Leitprojekt Vernetztes Studium - Chemie
BMBF-Leitprojekt Vernetztes Studium - Chemie