| Titration einer starken Säure |
| Neutralisationreaktionen lassen sich für die quantitative Analyse
nutzen. Ein Beispiel: Es liegt ein bestimmtes Volumen einer Salzsäurelösung
mit unbekannter Stoffmenge n(HCl)0 vor. Man
gibt nun schrittweise kleine Volumina NaOH-Maßlösung (Lösung
mit bekannter Konzentration) zu, bis die Salzsäure neutralisiert
ist (pH = 7). Da die OH–-Konzentration und das verbrauchte
Volumen der NaOH-Maßlösung bekannt sind, lässt sich nun
bestimmen, welche Stoffmenge n(HCl)0 vor der Basenzugabe
in der Lösung war: |
| n(OH–-zugegeben) = [NaOH-Maßlösung]·V(zugegeben) = n(HCl)0
|
Ein Verfahren, bei dem einer Lösung unbekannter Konzentration eine Maßlösung
bis zu einem definierten Endzustand zugegeben wird, um daraus die Konzentration
zu bestimmen, wird Titration genannt. Die graphische
Auftragung des pH-Wertes gegen das Volumen zugegebener Maßlösung
wird Titrationskurve genannt.
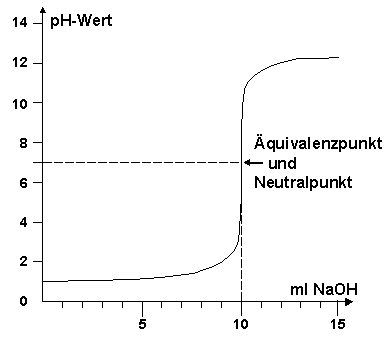 |
Titrationskurve von 10 ml Salzsäure mit
0,1 M NaOH
Nach Zugabe von 10 ml Maßlösung ist der Äquivalenzpunkt erreicht
®
n(HCl)0 = 0,001 mol; [HCl]0 = 0,1 M
|
Der pH-Wert steigt zuerst nur sehr langsam an (logarithmische Darstellung!).
Der definierte Endzustand wird bei Titrationen Äquivalenzpunkt
(ÄP) genannt und entspricht dem Wendepunkt der dargestellten Titrationskurve.
Allgemein ist er definiert, als Punkt bei dem die Stoffmenge der zugegebenen
Maßlösung gleich der Stoffmenge der titrierten Substanz ist. Bei
der Titration starker Säuren mit starken Basen – und umgekehrt – fällt
der Äquivalenzpunkt mit dem Neutralpunkt (pH
= 7) zusammen, denn es liegt eine neutrale Salzlösung vor. Wird, nachdem
der Äquivalenzpunkt erreicht wurde, weiterhin Natronlauge zugegeben,
bestimmt das überschüssige NaOH den pH-Wert.
In Versuchen wird häufig ein Indikator eingesetzt, der seinen Umschlagsbereich
beim pH-Wert des Äquivalenzpunktes hat. Da sich in diesem Bereich der
pH schon bei beim Zufügen geringer Volumina Maßlösung stark
ändert (ein Tropfen kann für den Farbumschlag genügen), führen
Indikatoren mit Umschlagsbereichen zwischen 5 und 9 zu recht genauen Messungen.
© Prof. Dr. J. Gasteiger, S. Spycher, CCC Univ. Erlangen, Fri Mar 30 11:41:56 2001 GMT
 BMBF-Leitprojekt Vernetztes Studium - Chemie BMBF-Leitprojekt Vernetztes Studium - Chemie
|


 BMBF-Leitprojekt Vernetztes Studium - Chemie
BMBF-Leitprojekt Vernetztes Studium - Chemie
