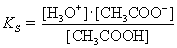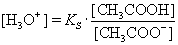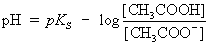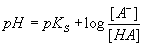Das Verhalten einer Pufferlösung lässt sich auch quantitativ beschreiben.
Ausgehend vom Massenwirkungsgesetz für die Dissoziation einer Säure
erhält man für den Acetat-Puffer:
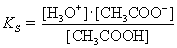 |
umformen ® |
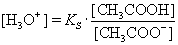 |
logarithmieren ® |
Die Gleichung zeigt, dass der pH-Wert der Pufferlösung vom pKS-Wert
der Essigsäure und vom Verhältnis Essigsäure/Acetat bestimmt
wird. In allgemeiner Form ist die Puffergleichung als Henderson-Hasselbalch-Gleichung
bekannt.
Liegt zum Beispiel in einem Acetat-Puffer Essigsäure mit einer Konzentration
von 0,1 mol/l und Acetat mit 0,5 mol/l vor, lässt sich über die
Puffergleichung der pH-Wert bestimmen: pH = 4,8 + log 5 = 5,5.
Liegen Säure und konjugierte Base in gleicher Konzentration vor, so ist
[HA]/[A–] gleich eins und die Puffergleichung wird zu pH = pKS.
Die Pufferlösung kann bei diesem pH-Wert Säuren- und Basenzugaben
gleich gut abpuffern. Liegt die Säure in zehnfach höherer Konzentration
vor, so gilt pH = pKS - 1. Der Puffer wirkt
dann effektiv gegen die Zugabe von Basen, kann aber nur noch geringe Mengen
Säure abpuffern. Als Faustregel gilt deshalb für den optimalen Einsatzbereich
von Pufferlösungen: pH = pKS ± 1
(= Pufferbereich).
Da sich der Pufferbereich in der Titrationskurve deutlich abzeichnet, lässt
sich anhand von Titrationskurven der pKS-Wert schwacher Säuren
oder Basen ermitteln (geringste Steigung der Kurve).


 BMBF-Leitprojekt Vernetztes Studium - Chemie
BMBF-Leitprojekt Vernetztes Studium - Chemie