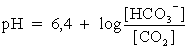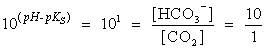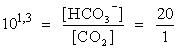Kohlendioxid (CO2) und Wasser sind die mengenmässig wichtigsten
Endprodukte des Stoffwechsels. Im Wasser gelöstes Kohlendioxid reagiert
zur zweiprotonigen Kohlensäure (1), welche in einer zweiten Reaktion
dissoziiert (2).
| (1) |
CO2 + H2O |
|
H2CO3 |
|
pK = 3,1 |
| (2) |
H2CO3 + H2O |
|
HCO3– + H3O+ |
|
pKS1 = 3,3 |
| Gesamtreaktion |
CO2 + 2 H2O |
|
HCO3– + H3O+ |
|
pKS = 6,4 |
Das Gleichgewicht der ersten Reaktion liegt auf der linken Seite (pK = 3,1).
Löst man also Kohlendioxid in Wasser liegt es vorwiegend als CO2
und nur zu einem geringen Teil als H2CO3 vor.
Reaktion (1) und (2) lassen sich zusammenziehen und die pK-Werte addieren.
Das Gleichgewicht der Gesamtreaktion liegt noch stärker auf der linken
Seite: gelöstes Kohlendioxid reagiert als schwache Säure. Die konjugierte
Base ist das Hydrogencarbonat, auch Bicarbonat genannt.
Kohlendioxid und Bicarbonat bilden ein Puffersystem mit pH-Optimum bei pH = 6,4.
|
Das Kohlendioxid-Bicarbonatpuffersystem ist das bedeutendste Puffersystem des Blutes,
das auf einen pH von 7,4 gepuffert ist. Das Konzentrationsverhältnis der Puffersubstanzen bei
pH = 7,4 lässt sich somit berechnen:
Die Reaktionskonstante ist temperaturabhängig; der pKS der
Gesamtreaktion beträgt im Blut bei 37 °C 6,1
statt 6,4 bei 25 °C. Das Konzentrationsverhältnis
wird dann zu:
Es liegt also ein Überschuss an Bicarbonat vor, sodass das Puffersystem vor
allem gegen H3O+-Ionen wirkt. Da CO2 ein
Gas ist, steht das gelöste CO2 im Gleichgewicht mit dem CO2
der Luft in der Lunge. Hier zeigt sich eine Besonderheit dieses Puffersystems.
Es kann nämlich nicht nur H3O+-Ionen am Entstehungsort
abpuffern, sondern auch das Reaktionsprodukt aus dem Gleichgewicht entfernen:
| H3O+ + HCO3– |
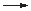 |
CO2 |
 |
+ H2O |
Der senkrechte Pfeil deutet an, dass das Kohlendioxid die Lösung verlässt
und in die Gasphase geht (das System verlässt). Man spricht deshalb auch
von einem offenen Puffersytem.


 BMBF-Leitprojekt Vernetztes Studium - Chemie
BMBF-Leitprojekt Vernetztes Studium - Chemie