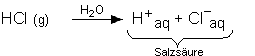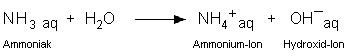|
Säuren und Basen: Beispiele |
|
Zwei Beispiele sollen als Einstieg illustrieren, worauf die Gemeinsamkeit
von Säuren und Basen beruht:
| Chlorwasserstoff, HCl: Bei Raumtemperatur ist HCl
ein Gas (Siedepunkt: - 84 °C). Reiner flüssiger
Chlorwasserstoff ist viel weniger leitfähig als eine Salzlösung,
das heisst, es liegen kaum Ionen vor. Anders sieht die Situation aus,
wenn man HCl in Wasser löst: |
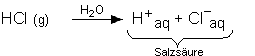 |
|
Das HCl-Molekül dissoziiert in Wasser unter Bildung
von hydratisierten Wasserstoff-Ionen (= Protonen) und hydratisierten
Chlorid-Ionen. Eine wässrige Chlorwasserstofflösung hat deshalb
eine hohe Leitfähigkeit. Chlorwasserstoff hat die Eigenschaften einer
Säure, seine Lösung wird Salzsäure genannt. |
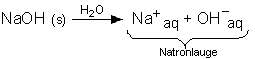
Natriumhydroxid, NaOH: Löst man festes NaOH in Wasser bildet sich
Natronlauge:
|
 |
|
Natronlauge besteht aus hydratisierten Natrium- und Hydroxid-Ionen.
Natriumhydroxid hat die Eigenschaften einer Base. |
| Ende des 19. Jahrhunderts wurde folgende Definition für Säuren
und Basen verwendet: Säuren geben in Wasser H+, Basen OH–
ab. Die Definition ist allerdings unzureichend, weil z.B. wässrige
Ammoniaklösungen auch basisch reagieren, obwohl Ammoniak keine OH–-Ionen
enthält. |
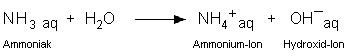 |
| Die Definition muss also erweitert werden, indem das Lösungsmittel
mit einbezogen wird. |
© Prof. Dr. J. Gasteiger, S. Spycher, CCC Univ. Erlangen, Fri Mar 30 11:41:49 2001 GMT
 BMBF-Leitprojekt Vernetztes Studium - Chemie BMBF-Leitprojekt Vernetztes Studium - Chemie
|


 BMBF-Leitprojekt Vernetztes Studium - Chemie
BMBF-Leitprojekt Vernetztes Studium - Chemie