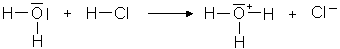Der Däne Johannes Brønsted und der Engländer Thomas Lowry
haben erkannt, dass die Übertragung von Protonen das wesentliche Merkmal
der Reaktionen von Säuren und Basen ist.
Die Lowry-Brønsted-Definition für Säuren und Basen wird heute
allgemein verwendet:
|
Säuren
geben Protonen ab: Protonendonatoren
|
|
|
Basen
nehmen Protonen auf: Protonenakzeptoren
|
| Bei chemischen Reaktionen treten keine freien Protonen auf. Wenn ein Stoff
Protonen abgibt, muss stets ein Stoff vorhanden sein, der die Protonen aufnimmt.
In wässrigen Lösungen werden die Protonen von den Wassermolekülen
aufgenommen und es entstehen Hydronium-Ionen.
|
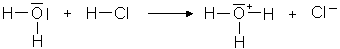 |
Allgemein gilt:
|
Säure-Base-Reaktionen
sind Protonenübertragungsreaktionen
|
Die H3O+-Ionen sind wie alle Ionen in wässriger
Lösung hydratisiert (H3O+aq ).
Beim Schreiben von Gleichungen bleibt dies aber unberücksichtigt.
Die Hydronium-Ionen-Konzentration wird oftmals nur als Wasserstoffionenkonzentration
[H+] bezeichnet. Insbesonders bei organischen und biochemischen
Reaktionen wird der Übersichtlichkeit halber nur H+ geschrieben.


 BMBF-Leitprojekt Vernetztes Studium - Chemie
BMBF-Leitprojekt Vernetztes Studium - Chemie